Formule d'oxyde cuivrique, propriétés, risques et utilisations
Le oxyde cuivrique, également appelé oxyde de cuivre (II), est un composé chimique de formule CuO. Sa structure est illustrée à la figure 1 (EMBL-EBI, 2017).
L'oxyde cuivrique se trouve dans la nature comme l'un des composants des minéraux tels que la ténorite et la paramelaconite. Il est extrait de minéraux dans le monde entier, principalement en Amérique du Sud, dans des pays tels que le Pérou, la Bolivie.
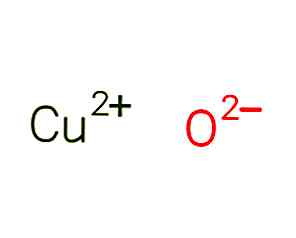
Certains composés chimiques tels que le carbonate d'ammonium et l'ammoniac sont utilisés pour favoriser l'extraction des minéraux.

L'oxyde cuivrique est produit principalement par extraction dans les minéraux, mais il existe un procédé pour le produire industriellement.
Dans les industries, l'oxyde cuivrique est préparé par la réaction d'allumage du nitrate cuivrique trihydraté (100-20 ° C), de l'hydroxyde cuivrique (100 ° C) ou du carbonate de cuivre (250 ° C):
2Cu (NON3)2 → 2CuO + 4NO2 + O2
Cu (OH)2(s) → CuO (s) + H2O (l)
Coucou3 → CuO + CO2
Il est également préparé par synthèse en chauffant du cuivre métallique dans l'air à environ 800 ° C (formule à l'oxyde cuivrique, S.F.).
Propriétés physiques et chimiques de l'oxyde cuivrique
Copper (II) oxide Il se présente sous la forme d'une fine poudre noire à structure ionique. Son apparence est illustrée à la figure 3.

La molécule est formée par le cuivre cationique divalent Cu + 2 et l'oxygène anionique O-2. Les molécules forment un système cristallin monoclinique, où chaque atome de cuivre est coordonné par 4 atomes d'oxygène.
Il est étroitement lié à l'autre oxyde de cuivre: l'oxyde cuivreux Cu2O (Centre national d'information sur la biotechnologie, 2005).
Son poids moléculaire est de 79,545 g / mol et sa densité est de 6,315 g / ml. Son point de fusion est de 1326 ° C où il se décompose en libérant de l'oxygène, son point d'ébullition est supérieur à 2000 ° C.
Le composé est insoluble dans l'eau, l'alcool, l'hydroxyde d'ammonium, le carbonate d'ammonium et est soluble dans le chlorure d'ammonium et le cyanure de potassium (Royal Society of Chemistry, 2015).
L'oxyde de cuivre est amphotère, il peut donc se dissoudre dans les acides et les solutions alcalines. En solution alcaline, il réagit pour former d'autres sels de cuivre:
2MetalOH + CuO + H2O → Métal2[Cu (OH)4]
Dans les solutions acides, il réagit également pour former d'autres sels de cuivre:
CuO + 2HNO3 → Cu (NO3)2 + H2O
CuO + 2HCl → CuCl2 + H2O
Il explose lorsqu'il est chauffé au contact de l'aluminium, de l'hydrogène ou du magnésium. En outre, lorsqu'il est chauffé, il produit des vapeurs toxiques.
Réactivité et dangers
L'oxyde de cuivre (II) est extrêmement toxique et toxique par ingestion. Il endommage le système nerveux central et le système endocrinien (AZoM, 2013).
Il est également irritant pour les yeux et la peau. Il est ininflammable, stable et incompatible avec les agents réducteurs, le sulfure d'hydrogène, l'aluminium, les métaux alcalins, les métaux en poudre fine (Fisher scientiffic, 2009).
En cas de contact avec les yeux, vérifiez si vous portez des lentilles de contact et retirez-les immédiatement.
Les yeux doivent être rincés à l'eau courante pendant au moins 15 minutes, en gardant les paupières ouvertes. Vous pouvez utiliser de l'eau froide. La pommade ne doit pas être utilisée pour les yeux.
Si le produit chimique entre en contact avec les vêtements, retirez-le le plus rapidement possible en protégeant vos propres mains et votre corps. Placez la victime sous une douche de sécurité.
Si le produit chimique s'accumule sur la peau exposée de la victime, comme les mains, lavez délicatement et soigneusement la peau contaminée par de l'eau courante et du savon non abrasif.
Vous pouvez utiliser de l'eau froide. Si l'irritation persiste, consulter un médecin. Laver les vêtements contaminés avant de les réutiliser.
Si le contact avec la peau est grave, il convient de le laver avec un savon désinfectant et de couvrir la peau contaminée par une crème antibactérienne.
En cas d'inhalation, la victime devrait pouvoir se reposer dans un endroit bien ventilé. Si l'inhalation est grave, la victime devrait être évacuée dans un endroit sûr dès que possible.
Détachez les vêtements serrés tels que le col de la chemise, les ceintures ou les cravates. Si la victime a du mal à respirer, de l'oxygène doit être administré.
Si la victime ne respire pas, une réanimation du bouche à bouche est effectuée. Toujours en tenant compte du fait qu'il peut être dangereux pour la personne fournissant de l'aide de faire une réanimation du bouche à bouche lorsque le matériau inhalé est toxique, infectieux ou corrosif.
En cas d'ingestion, ne pas faire vomir. Détachez les vêtements serrés tels que les cols, les ceintures ou les cravates. Si la victime ne respire pas, effectuez une réanimation bouche à bouche.
Dans tous les cas, une attention médicale immédiate doit être recherchée (fiche de données de sécurité: oxyde de cuivre, 2013).
Utilise
L'oxyde cuivrique est utilisé comme pigment pour les cristaux, les émaux de porcelaine et les gemmes artificielles. L'oxyde ajoute une teinte bleuâtre à verdâtre à ces matériaux.
Il est également utilisé comme agent désulfurant pour les gaz de pétrole et comme catalyseur d'oxydation et dans les électrodes galvaniques (Encyclopædia Britannica, 2017).
L'oxyde cuivrique est largement utilisé dans les industries chimiques et agricoles chimiques pour produire des produits intermédiaires dans certains procédés.
C'est un agent oxydant / réducteur largement utilisé et un régulateur du processus dans la réaction chimique, en particulier dans la production de pétrole.
L'oxyde cuivrique est utilisé pour produire des peintures et des revêtements et est également un ingrédient de certains produits pour le traitement de l'air.
Rarement utilisé comme complément alimentaire chez les animaux, il peut également être utilisé comme semi-conducteur de type p en raison de sa bande interdite étroite. Il est utilisé comme alternative à l'oxyde de fer dans les termites.
En raison de ses propriétés fongicides et microbicides, l'oxyde de cuivre (II) est également utilisé comme insecticide et fumigant.
Il est principalement utilisé dans le traitement des plants de pomme de terre et comme agent antisalissure dans les coques de navires. Un agent antisalissure est un matériau qui empêche la formation de balanes et d’autres organismes au fond d’un navire.
Lorsque ces organismes se développent dans la coque d'un navire, ils augmentent la friction produite lorsque le navire traverse l'eau, réduisant ainsi sa vitesse.
Le composé est également utilisé comme agent de conservation du bois pour protéger les piquets de clôture, les copeaux, le platelage, la toiture, les bardeaux, les digues et autres structures d'eau douce et marines d'insectes et de champignons. (Thomson Gale, 2006).
Références
- (2013, 21 août). Semi-conducteurs en oxyde de cuivre (II). Récupéré de azom.com.
- Formule d'oxyde cuivrique. (S.F.). Récupéré depuis softschools.com.
- EMBL-EBI (2017, 2 février). oxyde de cuivre (II). Récupéré de ChEBI.ac.uk.
- Encyclopædia Britannica. (2017, 16 mai). Cuivre (Cu). Récupéré de britannica.com.
- Fisher scientiffic. (2009, 20 septembre). Fiche signalétique Oxyde de cuivre (II). Récupéré de fke.uitm.edu.my.my.
- Fiche signalétique Oxyde cuivrique. (2013, 21 mai). Récupéré de sciencelab.com.
- Centre national d'information sur la biotechnologie ... (26 mars 2005). PubChem Compound Database; CID = 14829. Récupéré de PubChem.
- Société royale de chimie. (2015). Oxyde de cuivre (II). Récupéré de chemspider.com.
- Thomson Gale. (2006). Cuivre (II) Oxyde. Récupéré de encyclopedia.com.


