Structure chimique, utilisations, propriétés de l'oxyde d'aluminium (Al2O3)
Le oxyde d'aluminium (Al2O3 de formule chimique), également appelée alumine, oxyde d'aluminium, corindon ou trioxyde d'aluminium, est un oxyde métallique produit par la réaction entre un métal et l'oxygène (O). Il est également connu sous le nom d'oxyde de base, pour la facilité de formation d'hydroxydes quand ils réagissent avec l'eau.
En effet, l'aluminium de la famille IIIA du tableau périodique a tendance à donner les électrons du dernier niveau d'énergie. Cette tendance est due à sa nature métallique et à sa faible électronégativité (1,61 sur l’échelle de Pauling), ce qui lui confère des propriétés électropositives et le convertit en un cation.

En revanche, l'oxygène est un non-métal et est plus électronégatif en raison de sa haute électronégativité (3,44 sur l'échelle de Pauling). Par conséquent, il a tendance à stabiliser l'énergie électronique de son dernier niveau en acceptant des électrons, ce qui en fait un anion.
Les liaisons formées sont des liaisons fortes, ce qui confère à l'oxyde d'aluminium une grande résistance. Dans la nature, l'aluminium ne se trouve pas sous forme native, comme l'or, l'argent, le cuivre, le soufre et le carbone (diamant).
Cela signifie que l’aluminium n’est associé à aucun autre élément; Ce métal est mélangé à de l'oxygène, formant des composés tels que le corindon ou l'émeri, qui sont des composés hautement résistants et abrasifs.
Index
- 1 Formule et structure chimique
- 2 propriétés physiques
- 3 propriétés chimiques
- 4 utilisations
- 5 références
Formule et structure chimique
Formule moléculaire: Al2O3
Formule structurelle: 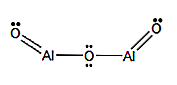
Propriétés physiques
- Il est disponible dans le commerce sous forme de poudre blanche, inodore et non toxique.
- En tant que composé minéral correspond au groupe d'hématite. C'est un matériau très dur qui résiste très bien à l'usure, il est donc utilisé comme matériau abrasif.
- Il conduit facilement l'électricité et est également un bon conducteur thermique.
- Il résiste aux réactions avec les acides et les bases à haute température.
- Il peut apparaître en différentes couleurs: rouge ou rubis (où les ions aluminium ont été remplacés par du Cr3+), jaune, rose, bleu saphir, violet, vert, gris et même incolore.
- Sa brillance est vitreuse ou adamantine (diamant)
- Il a une bande blanche très délicate en raison de sa dureté.
- Sa dureté dans l’échelle de Mohs est de 9. Cela signifie qu’il peut rayer d’autres minéraux de dureté inférieure; Cependant, il ne peut pas rayer le diamant qui a une dureté de 10 sur la même échelle.
- Sa densité est de 3,96 g / cm3
- son poids moléculaire (masse molaire) est de 101,96 g / mol.
- Son point de fusion est 2040 ° C
- Son point d'ébullition est de 2977 ° C
- Il est insoluble dans l'eau.
Propriétés chimiques
L'oxyde d'aluminium ne réagit pas avec l'eau, sauf en présence d'une base forte.
Cependant, lorsqu'il réagit avec les acides, il se comporte comme une base:

Il montre également des propriétés acides lorsqu'il réagit avec les bases:

Bien que l’eau ne soit pas formée dans cette réaction, elle est considérée comme acide car Al2O3 neutralise NaOH. Par conséquent, le Al2O3 Il est classé comme un oxyde amphotère car il possède des propriétés acides et basiques.
Dans la formation des alcènes et des cycloalcènes, l'une des formes les plus utilisées dans l'industrie et les laboratoires est la déshydratation des alcools.
Pour cela, de la vapeur d’alcool circule sur un catalyseur chaud d’alumine ou d’oxyde d’aluminium (Al2O3); dans ce cas, il est considéré comme un acide de Lewis.

Utilise
- L’alumine est utilisée dans l’industrie pour obtenir de l’aluminium.
- Il est utilisé comme matériau céramique en raison de sa haute résistance à la corrosion à haute température et à l’usure.
- Il est utilisé comme isolant thermique, notamment dans les cellules électrolytiques.
- Il a la capacité d'absorber de l'eau, ce qui le rend apte à être utilisé comme agent de séchage.
- Il est utilisé comme agent catalytique dans les réactions chimiques
- En raison de sa grande stabilité thermique, il est utilisé comme oxydant dans les réactions chimiques à haute température.
- Empêche l'oxydation des bornes cathodiques et anodiques dans une cellule électrolytique.
- En raison de sa grande dureté et de sa résistance, il est utilisé en dentisterie pour la préparation de pièces dentaires.
- C'est un bon isolant électrique dans les bougies d'allumage des véhicules fonctionnant à l'essence.
- Il est largement utilisé dans les broyeurs à boulets pour la préparation des céramiques et des émaux.
- En raison de sa légèreté, dans les processus d'ingénierie, il est utilisé pour fabriquer des avions.
- En raison de son point d'ébullition élevé, il est utilisé pour fabriquer des ustensiles de cuisine tels que des poêles à frire et des casseroles réfractaires.
- Il est utilisé dans l'instrumentation des machines d'essai thermique.
- Dans l'industrie électronique, il est utilisé dans la fabrication de composants passifs pour l'interconnexion électrique et dans la fabrication de résistances et de condensateurs.
- Utilisé dans la fabrication de charges pour le soudage.
- L'oxyde d'aluminium est utilisé pour le revêtement d'oxyde de titane (pigment utilisé pour les peintures et les papiers plastiques).Cela empêche les réactions entre l'environnement et ce type de pigments, qui ne se décomposent pas ou ne rouillent pas.
- Il est utilisé comme abrasif dans les dentifrices.
- Il est utilisé en hémodialyse.
- Comme additif dans l'industrie alimentaire, car il est utilisé comme agent dispersant.
- C'est un agent anti-transpirant des déodorants.
- L'oxyde d'aluminium a été utilisé comme matériau orthopédique. Comme il s'agit d'un matériau inerte et poreux, il est adapté à une utilisation dans ce type d'implants. Ces implants permettent la croissance fibrovasculaire, raison pour laquelle les fibroblastes et les ostéoblastes prolifèrent rapidement dans ce matériau.
- l'implant biocéramique est fabriqué avec de l'alumine. Il est léger et possède une structure de pores uniforme très bien interconnectée. La structure microcristalline est plus lisse que la surface rugueuse. Il présente moins d'inflammabilité après une période postopératoire par rapport aux autres matériaux utilisés pour les implants.
- Les paillettes d'oxyde d'aluminium produisent des effets réfléchissants à l'intérieur des peintures utilisées pour les automobiles.
- Dans certaines raffineries, l’oxyde d’aluminium est utilisé pour convertir les gaz toxiques de l’hydrogène sulfuré en soufre élémentaire.
- La forme d'alumine appelée alumine activée a de grands avantages dans le traitement des eaux usées que les aquifères en raison de leur capacité à adsorber de nombreux polluants nocifs pour l'environnement, et aussi de filtrer des matières résiduelles est dissous dans l'eau et est plus grand que le pore des feuilles d'alumine.
Références
- Chang, R; Chimie, 1992 (quatrième édition), Mexique. McGraw-Hill Interamericana de México.
- Pine.S; Hendrickson, J; Cram, D; Hammond, G (1980), Chimie Organique, (quatrième édition), Mexique, McGraw-Hill de México
- Kinjanjui, L., (s.f) Propriétés et utilisations de l'oxyde d'aluminium,Ça marche encore, Récupéré, itstillworks.com
- Panjian L., Chikara, O., Tadashi, K., Kazuki, N., Naohiro, S. et "Klaas de G., (1994). Le rôle de la silice hydratée, l'oxyde de titane et de l'alumine dans l'induction d'apatite sur des implants. Journal of Biomedicals Materials Research. Volume 18, pp. 7-15. DOI: 10.1002 / jbm.820280103.
- Guide d'information complet sur Rocks, Minerals & Gemstones., Mineral.net., Recovered, minerals.net
- LaNore, S. (2017), Caractéristiques physiques de l'oxyde d'aluminium, Sciencing,Récupéré, sciencing.com



