Théorie du modèle des bandes et exemples
Le théorie des bandes est celui qui définit la structure électronique du solide dans son ensemble. Il peut être appliqué à tout type de solide, mais c'est dans les métaux où ses plus grands succès se reflètent. Selon cette théorie, la liaison métallique résulte de l'attraction électrostatique entre les ions chargés positivement et les électrons mobiles dans le cristal.
Par conséquent, le cristal métallique a une "mer d'électrons", ce qui peut expliquer ses propriétés physiques. L'image inférieure illustre le lien métallique. Les points violets des électrons sont délocalisés dans une mer qui entoure les atomes de métal chargés positivement.

La "mer des électrons" est formée à partir des contributions individuelles de chaque atome de métal. Ces contributions sont ses orbitales atomiques. Les structures métalliques sont généralement compactes; plus ils sont compacts, plus les interactions entre leurs atomes sont grandes.
Par conséquent, leurs orbitales atomiques se chevauchent pour générer des orbitales moléculaires très étroites en énergie. La mer des électrons n'est alors qu'un ensemble important d'orbitales moléculaires avec différentes gammes d'énergies. La gamme de ces énergies constitue ce qu'on appelle des bandes d'énergie.
Ces bandes sont présentes dans toutes les régions du cristal, raison pour laquelle il est considéré dans son ensemble, et de là vient la définition de cette théorie.
Index
- 1 modèle de bandes d'énergie
- 1.1 Niveau de Fermi
- 2 semi-conducteurs
- 2.1 Semi-conducteurs intrinsèques et extrinsèques
- 3 Exemples de théorie des bandes appliquées
- 4 références
Modèle de bandes d'énergie

une liaison (bande verte) et une autre antiliant (bande rouge foncé): Lorsque l'orbitale s d'un atome de métal interagit avec son voisin (N = 2), deux orbitales moléculaires sont formés.
Si N = 3, forment maintenant trois orbitales moléculaires, dont celui du milieu (en bande noire) ne soit pas obligatoire. Si N = 4, quatre orbitales sont formées et en outre séparer le caractère de liaison plus élevée et plus le caractère de antienlanzante.
La gamme d'énergie disponible pour les orbitales moléculaires est en expansion à mesure que les atomes métalliques du cristal fournissent leurs orbitales. Cela se traduit également par une diminution de l'espace énergétique entre les orbitales, au point qu'elles se condensent dans une bande.
Ce groupe se compose de s orbitales a des régions de faible énergie (vert et jaune) et de haute énergie (orange et rouge). Leurs extrémités énergétiques ont une faible densité; cependant, la plupart des orbitales moléculaires (bande blanche) sont concentrées au centre.
Cela signifie que les électrons "courent plus vite" à travers le centre de la bande qu'à leurs extrémités.
Niveau de Fermi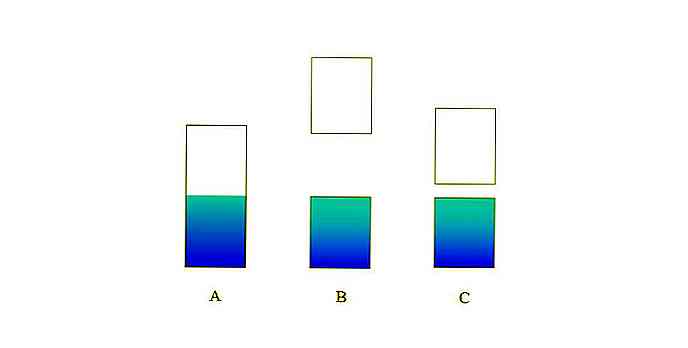
C'est l'état d'énergie le plus élevé occupé par les électrons dans un solide à la température zéro absolue (T = 0 K).
Une fois la bande S construite, les électrons commencent à occuper toutes leurs orbitales moléculaires. Si le métal a un seul électron de valence1), tous les électrons de son cristal occuperont la moitié de la bande.
L'autre moitié inoccupée est connue sous le nom de bande de conduite, tandis que la bande pleine d'électrons est appelée bande de valence.
Dans l'image supérieure, A représente une bande de valence typique (bleue) et une bande de conduction (blanche) pour un métal. La ligne frontière bleuâtre indique le niveau de Fermi.
Étant donné que les métaux ont également orbitales, ceux-ci sont combinés de la même manière à provoquer une bande w (blanc).
Dans le cas des métaux, les bandes s et p sont très proches en énergie. Cela permet à leurs chevauchements, en promouvant les électrons de la bande de valence à la bande de conduction. Ce qui précède se produit même à des températures légèrement supérieures à 0 K.
Pour les métaux de transition et à partir de la période 4 vers le bas, la formation de bandes d est également possible.
Le niveau de Fermi par rapport à la bande de conduction est très important pour déterminer les propriétés électriques.
Par exemple, un métal Z avec un niveau de Fermi très proche de la bande de conduction (la bande vide la plus proche en énergie) a une conductivité électrique plus élevée qu'un métal X dans lequel son niveau de Fermi est loin de cette bande.
Semi-conducteurs
La conductivité électrique consiste alors en la migration des électrons d’une bande de valence vers une bande de conduction.
Si l'écart énergétique entre les deux bandes est très important, vous avez un solide isolant (comme avec B). En revanche, si cet écart est relativement faible, le solide est un semi-conducteur (dans le cas de C).
Face à une augmentation de la température, les électrons de la bande de valence acquièrent suffisamment d'énergie pour migrer vers la bande de conduction. Cela se traduit par un courant électrique.
En fait, il s’agit d’une qualité de solides ou de matériaux semi-conducteurs: à la température ambiante, ce sont des isolants, mais à haute température, ils sont conducteurs.
Semi-conducteurs intrinsèques et extrinsèques

Les conducteurs intrinsèques sont ceux dans lesquels l'espace énergétique entre la bande de valence et la bande de conduction est suffisamment faible pour que l'énergie thermique permette le passage des électrons.
D'autre part, les conducteurs extrinsèques présentent des modifications de leurs structures électroniques après dopage avec des impuretés, ce qui augmente leur conductivité électrique. Cette impureté peut être un autre métal ou un élément non métallique.
Si l'impureté a plus d'électrons de valence, elle peut fournir une bande donneuse qui sert de pont aux électrons de la bande de valence pour traverser la bande de conduction. Ces solides sont des semi-conducteurs de type n. Ici, la dénomination n vient de "négatif".
Dans l'image supérieure, la bande donneuse est illustrée dans le bloc bleu situé juste en dessous de la bande passante (Type n).
D'autre part, si l'impureté a moins d'électrons de valence, elle fournit une bande d'accepteur, ce qui raccourcit l'intervalle d'énergie entre la bande de valence et la bande de conduction.
Les électrons migrent d'abord vers cette bande, laissant derrière eux des "trous positifs" qui se déplacent dans la direction opposée.
Comme ces écarts positifs marquent le passage des électrons, le solide ou le matériau est un semi-conducteur de type p.
Exemples de théorie des bandes appliquées
- Expliquez pourquoi les métaux sont brillants: leurs électrons mobiles peuvent absorber des rayonnements sur une large gamme de longueurs d’onde quand ils passent à des niveaux d’énergie plus élevés. Ensuite, ils émettent de la lumière et reviennent aux niveaux inférieurs de la bande de conduite.
- Le silicium cristallin est le matériau semi-conducteur le plus important. Si une portion de silicium est dopée avec des traces d'un élément du groupe 13 (B, Al, Ga, In, Tl), elle devient un semi-conducteur de type p. Alors que s'il est dopé avec un élément du groupe 15 (N, P, As, Sb, Bi), il devient un semi-conducteur de type n.
- Les diodes électroluminescentes (LED) sont des semi-conducteurs de joints p-n. Que voulez-vous dire? Que le matériau a les deux types de semi-conducteurs, à la fois le n et le p. Les électrons migrent de la bande de conduction du semi-conducteur de type n vers la bande de valence du semi-conducteur de type p.
Références
- Whitten, Davis, Peck & Stanley. Chimie (8ème éd.). CENGAGE Learning, p 486-490.
- Shiver & Atkins. (2008). Chimie inorganique (Quatrième édition., Pp. 103-107, 633-635). Mc Graw Hill.
- Ship C. R. (2016). Théorie des bandes de solides. Récupéré le 28 avril 2018 de: hyperphysics.phy-astr.gsu.edu
- Steve Kornic. (2011). Passer des liens aux bandes du point de vue du chimiste. Extrait le 28 avril 2018 de: chembio.uoguelph.ca
- Wikipedia. (2018). Semi-conducteur extrinsèque Récupéré le 28 avril 2018 de: en.wikipedia.org
- BYJU'S (2018). Théorie des bandes de métaux. Récupéré le 28 avril 2018 de: byjus.com



