Nomenclature des oxydes, types, propriétés et exemples
Le les oxydes ils sont une famille de composés binaires où il y a des interactions entre l'élément et l'oxygène. Ainsi, un oxyde a une formule très générale du type EO, où E est un élément quelconque.
En fonction de nombreux facteurs, tels que la nature électronique de E, son rayon ionique et leurs valences ils peuvent former différents types d'oxydes. Certains sont très simples, et d'autres, comme Pb3O4, (appelé minium, arcazón ou plomb rouge) sont mélangés; c'est-à-dire qu'elles résultent de la combinaison de plus d'un oxyde simple.

Mais la complexité des oxydes peut aller plus loin. Il existe des mélanges ou des structures dans lesquels plus d'un métal peut intervenir et, en outre, les proportions ne sont pas stoechiométriques. Dans le cas de Pb3O4, le rapport Pb / O est égal à 3/4, dont le numérateur et le dénominateur sont des nombres entiers.
Dans les oxydes non stœchiométriques, les proportions sont des nombres décimaux. Le e0.75O1.78, est un exemple d'un oxyde non stoechiométrique hypothétique. Ce phénomène se produit avec ce qu'on appelle des oxydes métalliques, en particulier les métaux de transition (Fe, Au, Ti, Mn, Zn, etc.).
Cependant, il existe des oxydes dont les caractéristiques sont beaucoup plus simples et différenciables, de même que le caractère ionique ou covalent. Dans les oxydes où prédomine le caractère ionique, ils seront composés de cations E+ et anions O2-; et celles purement covalentes, les liaisons simples (E-O) ou doubles (E = O).
Ce qui dicte le caractère ionique d'un oxyde est la différence d'électronégativité entre E et O. Lorsque E est un métal très électropositif, alors EO aura un caractère ionique élevé. Alors que si E est électronégatif, à savoir un non-métal, son oxyde EO sera covalent.
Cette propriété définit beaucoup d'autres produits par les oxydes, de même que leur capacité à former des bases ou des acides en solution aqueuse. De là proviennent les oxydes dits basiques et acides. Ceux qui ne se comportent pas comme non plus, ou au lieu d'exprimer les deux caractéristiques sont des oxydes neutres ou amphotères.
Index
- 1 nomenclature
- 1.1 Nomenclature systématique
- 1.2 Nomenclature des stocks
- 1.3 Nomenclature traditionnelle
- 2 types d'oxydes
- 2.1 oxydes basiques
- 2.2 Oxydes acides
- 2.3 Oxydes neutres
- 2.4 oxydes amphotères
- 2.5 oxydes mixtes
- 3 propriétés
- 4 Comment sont-ils formés?
- 5 exemples d'oxydes
- 5.1 oxydes de métaux de transition
- 5.2 Exemples supplémentaires
- 6 références
Nomenclature
Il y a trois façons de mentionner les oxydes (qui s'appliquent également à de nombreux autres composés). Celles-ci sont correctes quel que soit le caractère ionique de l'oxyde d'oxyde d'éthylène, donc leurs noms ne disent rien sur leurs propriétés ou leurs structures.
Nomenclature systématique
Étant donné les oxydes EO, E2O, E2O3 et EO2À première vue, ce qui se cache derrière leurs formules chimiques ne peut être connu. Cependant, les chiffres indiquent les proportions stoechiométriques ou le rapport E / O. A partir de ces nombres, on peut leur donner des noms bien que cela ne soit pas spécifié avec quelle valence "fonctionne" E.
Les nombres d'atomes pour E et O sont indiqués par les préfixes numériques grecs. De cette manière, mono- signifie qu'il n'y a qu'un seul atome; di-, deux atomes; tri-, trois atomes, etc.
Ensuite, les noms des oxydes précédents selon la nomenclature systématique sont les suivants:
-MonóE (EO) oxyde.
-Monóxido diE (E2O).
-Trioxyde de diE (E2O3).
-DiE oxyde (EO2).
Appliquer ensuite cette nomenclature pour le Pb3O4, l'oxyde rouge de la première image, nous avons:
Pb3O4: tetraoxyde de triPlomb
Pour de nombreux mixtes ou des oxydes élevés de rapports stoechiométriques, il est utile d'utiliser la nomenclature systématique pour nommer.
Nomenclature des stocks
Valence
Bien que l'on ne sache pas quel élément est E, il suffit du rapport E / O pour savoir quelle valence il utilise dans son oxyde. Comment? Par le principe de l'électroneutralité. Cela nécessite que la somme des charges des ions dans un composé soit égale à zéro.
Cela se fait en supposant un caractère ionique élevé pour tout oxyde. Ainsi, le O a la charge -2 car c'est O2-et E doit fournir n + pour neutraliser les charges négatives de l’oxyde d’oxyde.
Par exemple, dans l'OE, l'atome E fonctionne avec la valence +2. Parce que? Parce que sinon il ne pourrait pas neutraliser la charge -2 du seul O. Pour le E2Ou, le E a valence +1, puisque la charge +2 doit être divisée entre les deux atomes de E.
Et dans le E2O3, il faut d'abord calculer les charges négatives apportées par les O. Comme trois d'entre elles, alors: 3 (-2) = -6.Pour neutraliser la charge -6, il est nécessaire que E fournisse +6, mais parce qu'il y en a deux, +6 est divisé par deux, laissant E avec une valence de +3.
Règle mnémonique
O a toujours une valence -2 dans les oxydes (sauf s'il s'agit d'un peroxyde ou d'un superoxyde). Donc, une règle mnémonique pour déterminer la valence de E consiste simplement à prendre en compte le nombre qui accompagne l'O.
Par exemple, dans EO, la valence de E est +1, car même si ce n'est pas écrit, il n'y a qu'un seul O. Et pour l'OE2, puisqu'il n'y a pas 2 E accompagnant, il y a eu une simplification, et pour le faire apparaître, il faut le multiplier par 2. Ainsi, la formule reste comme E2O4 et la valence de E est alors +4.
Cependant, cette règle échoue pour certains oxydes, tels que Pb3O4. Par conséquent, il est toujours nécessaire d'effectuer les calculs de neutralité.
En quoi consiste
Une fois la valence de E à portée de main, la nomenclature des stocks consiste à la spécifier entre parenthèses et en chiffres romains. De toutes les nomenclatures, c'est la plus simple et la plus précise en ce qui concerne les propriétés électroniques des oxydes.
Si E, par contre, n'a qu'une seule valence (qui peut être trouvée dans le tableau périodique), alors elle n'est pas spécifiée.
Ainsi, pour l'oxyde EO si E a valence +2 et +3, on l'appelle: oxyde de (nom de E) (II). Mais si E n'a que valence +2, alors son oxyde est appelé: oxyde (nom de E).
Nomenclature traditionnelle
Pour mentionner le nom des oxydes, les suffixes -ico ou -oso, pour les valences plus grandes ou plus petites, doivent être ajoutés à leurs noms latins. Dans le cas où il y en a plus de deux, alors les préfixes -hype, pour le plus petit, et -per, pour le plus grand de tous sont utilisés.
Par exemple, le plomb fonctionne avec les valences +2 et +4. Dans le PbO, il a une valence de +2, on l'appelle donc: oxyde de plomb. Alors que le PbO2 Il s'appelle: Oxyde de Plumique.
Et le pb3O4, comment est-il appelé selon les deux nomenclatures précédentes? Il n'a pas de nom. Parce que? Parce que le pb3O4 consiste en fait en un mélange 2 [PbO] [PbO2]; c'est-à-dire que le solide rouge a une double concentration de PbO.
Pour cette raison, il serait faux d'essayer de donner un nom au Pb3O4 cela ne consiste pas en une nomenclature systématique ou en un argot populaire.
Types d'oxydes
Selon la partie du tableau périodique qui est E et, par conséquent, sa nature électronique, un type d'oxyde ou un autre peut être formé. De là, des critères multiples leur sont assignés pour leur attribuer un type, mais les plus importants sont ceux liés à leur acidité ou à leur basicité.
Oxydes basiques
Les oxydes basiques sont caractérisés par le fait qu'ils sont ioniques, métalliques et, plus important, génèrent une solution basique lorsqu'ils sont dissous dans l'eau. Pour déterminer expérimentalement si un oxyde est basique, il faut l’ajouter à un récipient contenant de l’eau et un indicateur universel dissous. Sa coloration avant d'ajouter l'oxyde doit être verte, pH neutre.
Une fois l'oxyde ajouté à l'eau, si sa couleur passe du vert au bleu, cela signifie que le pH est devenu basique. En effet, il établit un équilibre de solubilité entre l'hydroxyde formé et l'eau:
EO (s) + H2O (l) => E (OH)2(s) <=> E2+(ac) + OH-(ac)
Bien que l'oxyde soit insoluble dans l'eau, il suffit qu'une petite partie se dissolve pour modifier le pH. Certains oxydes basiques sont tellement solubles qu'ils génèrent des hydroxydes caustiques tels que NaOH et KOH. C'est à dire, les oxydes de sodium et de potassium, Na2O et K2Ou, ils sont très basiques. Notez la valence de +1 pour les deux métaux.
Oxydes acides
Les oxydes d'acides se caractérisent par un élément non métallique, sont covalents et génèrent également des solutions acides avec de l'eau. Encore une fois, son acidité peut être vérifiée avec l'indicateur universel. Si cette fois en ajoutant l'oxyde à l'eau, sa couleur verte devient rougeâtre, alors c'est un oxyde acide.
Quelle réaction a lieu? La suivante:
EO2(s) + H2O (l) => H2EO3(ac)
Un exemple d’oxyde d’acide, qui n’est pas un solide, mais un gaz, est le CO2. Quand il se dissout dans l'eau, il forme de l'acide carbonique:
CO2(g) + H2O (l) <=> H2CO3(ac)
De même, le CO2 Il ne s'agit pas d'anions O2- et cations4+, mais dans une molécule formée par des liaisons covalentes: O = C = O. C'est peut-être l'une des plus grandes différences entre les oxydes basiques et les acides.
Oxydes neutres
Ces oxydes ne changent pas la couleur verte de l'eau à pH neutre; c'est-à-dire qu'ils ne forment pas d'hydroxydes, ni d'acides en solution aqueuse. Certains d'entre eux sont: N2O, NO et CO. Comme le CO, ils ont des liaisons covalentes qui peuvent être illustrées par des structures de Lewis ou par toute théorie des liens.
Oxydes amphotères
Une autre façon de classer les oxydes dépend de leur réaction avec un acide ou non.L'eau est un acide très faible (et une base aussi), de sorte que les oxydes amphotères ne présentent pas "les deux côtés". Ces oxydes se caractérisent par une réaction à la fois avec les acides et les bases.
L'oxyde d'aluminium, par exemple, est un oxyde amphotère. Les deux équations chimiques suivantes représentent leur réaction avec des acides ou des bases:
Al2O3(s) + 3H2SO4(ac) => Al2(SO4)3(ac) + 3H2O (l)
Al2O3(s) + 2 NaOH (ac) + 3H2O (l) => 2 NaAl (OH)4(ac)
Le al2(SO4)3 est le sel de sulfate d'aluminium et NaAl (OH)4 un sel complexe appelé tétrahydroxyaluminate de sodium.
Oxyde d'hydrogène, H2Ou (eau), il est également amphotère, et ceci est démontré par son équilibre d'ionisation:
H2O (l) <=> H3O+(ac) + OH-(ac)
Oxydes mixtes
Les oxydes mixtes sont ceux qui consistent en le mélange d'un ou plusieurs oxydes dans le même solide. Le pb3O4 C'est un exemple d'entre eux. La magnétite, la foi3O4, est aussi un autre exemple d'oxyde mixte. La foi3O4 C'est un mélange de FeO et Fe2O3 en proportions 1: 1 (contrairement à Pb)3O4).
Les mélanges peuvent être plus complexes, générant ainsi une riche variété de minéraux oxydés.
Propriétés
Les propriétés des oxydes dépendent de leur type. Les oxydes peuvent être ioniques (En +O2-), tels que CaO (Ca2+O2-), ou covalente, telle que SO2, O = S = O.
De ce fait et de la tendance des éléments à réagir avec des acides ou des bases, un certain nombre de propriétés sont recueillies pour chaque oxyde.
En outre, ce qui précède se reflète dans les propriétés physiques telles que les points de fusion et d'ébullition. Les oxydes ioniques ont tendance à former des structures cristallines très résistantes à la chaleur, de sorte que leurs points de fusion sont élevés (supérieurs à 1000 ° C), tandis que le covalent fond à basse température, voire même des gaz ou des liquides.
Comment sont-ils formés?
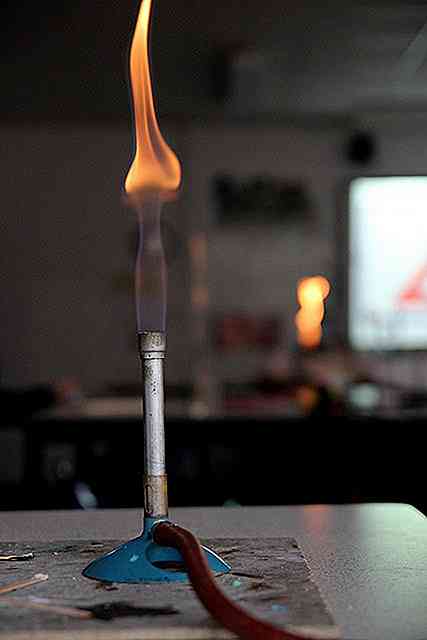
Les oxydes se forment lorsque les éléments réagissent avec l'oxygène. Cette réaction peut se produire avec un simple contact avec des atmosphères riches en oxygène, ou nécessite de la chaleur (comme la flamme d'un briquet). C'est-à-dire que lorsqu'un objet est brûlé, il réagit avec l'oxygène (tant qu'il est présent dans l'air).
Si un morceau de phosphore est pris, par exemple, et placé dans la flamme, il va brûler et former l'oxyde correspondant:
4P (s) + 5O2(g) => P4O10(s)
Pendant ce processus, certains solides, tels que le calcium, peuvent brûler avec une flamme vive et colorée.
Un autre exemple est obtenu en brûlant du bois ou toute substance organique qui possède du carbone:
C (s) + O2(g) => CO2g)
Mais s'il y a une insuffisance en oxygène, du CO se forme à la place du CO2:
C (s) + 1 / 2O2(g) => CO (g)
Notez comment le rapport C / O est utilisé pour décrire différents oxydes.
Exemples d'oxydes
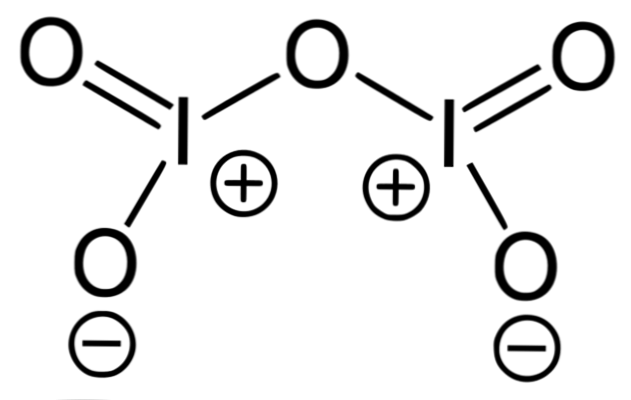
L'image supérieure correspond à la structure d'oxyde covalente I2O5, la forme la plus stable de l'iode. Notez ses liens simples et doubles, ainsi que les charges formelles de I et d'oxygène sur ses côtés.
Les oxydes d'halogène sont caractérisés par le fait qu'ils sont covalents et très réactifs, en tant que tels sont les cas de O2F2 (F-O-O-F) et OF2 (F-O-F). Dioxyde de chlore, ClO2, par exemple, est le seul oxyde de chlore synthétisé à des échelles industrielles.
Comme les halogènes forment des oxydes covalents, leurs valences "hypothétiques" sont calculées de la même manière par le principe de l'électroneutralité.
Oxydes de métaux de transition
En plus des oxydes d'halogène, nous avons les oxydes des métaux de transition:
-CoO: oxyde de cobalt (II); oxyde de cobalt; u le monoxyde de cobalt.
-HgO: oxyde de mercure (II); oxyde de mercure; u le monoxyde de mercure.
-Ag2O: oxyde d'argent; oxyde d'argent; ou diplata de monoxyde.
-Au2O3: oxyde d'or (III); oxyde aureique; ou dioro-trioxyde.
Exemples supplémentaires
-B2O3: oxyde de bore; oxyde borique; ou diboro trioxyde.
-Cl2O7: oxyde de chlore (VII); oxyde perchlorique; dichloro-heptoxyde.
-NO: oxyde d'azote (II); oxyde nitrique monoxyde d'azote.
Références
- Shiver & Atkins. (2008). Chimie inorganique (quatrième édition). Mc Graw Hill.
- Métaux et oxydes non métalliques. Tiré de: chem.uiuc.edu
- Chimie gratuite en ligne. (2018). Oxydes et Ozone. Tiré de: freechemistryonline.com
- Toppr. (2018). Oxydes simples. Tiré de: toppr.com
- Steven S. Zumdahl. (7 mai 2018). Oxyde Encyclopédie Britannica. Tiré de: britannica.com
- Chimie LibreTexts. (24 avril 2018). Les oxydes Tiré de: chem.libretexts.org
- Quimicas.net (2018). Exemples d'oxydes. Récupéré de: quimicas.net


