Oxydes d'azote (NOx) Différentes formulations et nomenclatures
Le oxydes d'azote ce sont essentiellement des composés inorganiques gazeux qui contiennent des liaisons entre les atomes d'azote et d'oxygène. Sa formule chimique est NONx, indiquant que les oxydes ont des proportions d'oxygène et d'azote différentes.
L'azote mène au groupe 15 du tableau périodique, tandis que le groupe d'oxygène 16; les deux éléments sont membres de la période 2. Cette proximité est la raison pour laquelle les liaisons N-O sont covalentes dans les oxydes. De cette manière, les liaisons dans les oxydes d’azote sont covalentes.
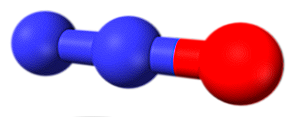
Tous ces liens peuvent être expliqués en utilisant la théorie de l’orbite moléculaire, qui révèle le paramagnétisme (un électron non apparié dans la dernière orbitale moléculaire) de certains de ces composés. Parmi ceux-ci, les composés les plus courants sont l'oxyde nitrique et le dioxyde d'azote.
La molécule dans l'image supérieure correspond à la structure angulaire en phase gazeuse du dioxyde d'azote (NO2). En revanche, l'oxyde nitrique (NO) a une structure linéaire (en considérant l'hybridation sp pour les deux atomes).
Les oxydes d'azote sont des gaz produits par de nombreuses activités humaines, de la conduite d'un véhicule ou de l'usage de la cigarette, à des procédés industriels en tant que déchets polluants. Cependant, le NO est naturellement produit par des réactions enzymatiques et des éclairs dans les orages: N2(g) + O2(g) => 2NO (g)
Les températures élevées des rayons brisent la barrière énergétique qui empêche cette réaction de se produire dans des conditions normales. Quelle barrière énergétique? Celle formée par la triple liaison N≡N, faisant la N-molécule2 un gaz inerte de l'atmosphère.
Index
- 1 Nombre d'oxydation de l'azote et de l'oxygène dans leurs oxydes
- 2 différentes formulations et nomenclatures
- 2.1 oxyde nitreux (N2O)
- 2.2 oxyde nitrique (NO)
- 2.3 Trioxyde d’azote (N2O3)
- 2.4 Tétroxyde d'azote et de dioxyde d'azote (NO2, N2O4)
- 2,5 pentoxyde de diazote (N2O5)
- 3 références
Nombres d'oxydation de l'azote et de l'oxygène dans leurs oxydes
La configuration électronique de l'oxygène est [He] 2s22p4, nécessitant seulement deux électrons pour compléter l'octet de sa coquille de valence; c'est-à-dire qu'il peut gagner deux électrons et avoir un nombre d'oxydation égal à -2.
Par contre, la configuration électronique de l'azote est [He] 2s22p3, être capable de gagner jusqu'à trois électrons pour remplir son octet de valence; par exemple, dans le cas de l'ammoniac (NH3) a un nombre d'oxydation égal à -3. Mais l'oxygène est beaucoup plus électronégatif que l'hydrogène et "force" l'azote à partager ses électrons.
Combien d’électrons l’azote peut-il partager avec l’oxygène? Si vous partagez les électrons de votre enveloppe de valence un par un, vous atteindrez la limite de cinq électrons, correspondant à un nombre d'oxydation de +5.
Par conséquent, en fonction du nombre de liaisons qu’il forme avec l’oxygène, le nombre d’oxydation de l’azote varie de +1 à +5.
Différentes formulations et nomenclatures
Les oxydes d'azote, en ordre croissant des nombres d'oxydation de l'azote, sont:
- N2Ou de l'oxyde nitreux (+1)
- NO, oxyde nitrique (+2)
- N2O3, trioxyde de diazote (+3)
- NON2, dioxyde d'azote (+4)
- N2O5, pentoxyde de diazote (+5)
Oxyde nitreux (N2O)
L'oxyde nitreux (communément appelé gaz hilarant) est un gaz incolore, légèrement odorant et peu réactif. Il peut être visualisé comme une molécule N2 (sphères bleues) qui a ajouté un atome d'oxygène à une extrémité. Il est préparé par décomposition thermique des sels de nitrate et est utilisé comme anesthésiant et analgésique.
L'azote a un nombre d'oxydation de +1 dans cet oxyde, ce qui signifie qu'il n'est pas très oxydé et que sa demande d'électrons n'est pas convaincante. Cependant, il vous suffit de gagner deux électrons (un pour chaque azote) pour devenir l'azote moléculaire stable.
Dans les solutions basiques et acides, les réactions sont les suivantes:
N2O (g) + 2H+(ac) + 2e- => N2(g) + H2O (l)
N2O (g) + H2O (l) + 2e- => N2(g) + 2OH-(ac)
Ces réactions, bien que thermodynamiquement, sont favorisées par la formation de la molécule stable N2, ils se produisent lentement et les réactifs qui donnent la paire d'électrons doivent être des agents réducteurs très puissants.
Oxyde nitrique (NO)
Cet oxyde est constitué d'un gaz incolore, réactif et paramagnétique. Comme l'oxyde nitreux, il a une structure moléculaire linéaire, mais avec la grande différence que la liaison N = O a également un caractère de triple liaison.
NO s'oxyde rapidement dans l'air pour produire NO2, et ainsi générer des orbitales moléculaires plus stables avec un atome d'azote plus oxydé (+4).
2NO (g) + O2(g) => 2NO2g)
Les études biochimiques et physiologiques sont à l’origine du rôle bénin de cet oxyde dans les organismes vivants.
On ne peut pas former des liaisons N-N avec une autre molécule de NO en raison de la délocalisation de l'électron non apparié dans l'orbitale moléculaire, qui est dirigée vers l'atome d'oxygène (pour sa forte électronégativité). Le contraire se produit avec le NO2, qui peut former des dimères gazeux.
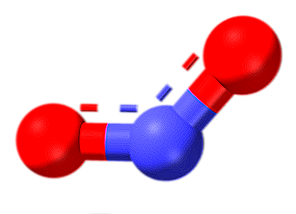
Trioxyde d'azote (N2O3)
Les lignes pointillées de la structure indiquent la résonance de la double liaison. Comme tous les atomes, ils ont une hybridation sp2La molécule est plane et interactions moléculaires sont suffisamment efficaces pour le trioxyde d'azote existe sous forme de solide bleu-dessous de -101 ° C À des températures plus élevées, il fond et se dissocie en NO et NO2.
Pourquoi est-ce dissocié? Étant donné que le nombre de deux et quatre oxydation sont plus stables que 3, ce dernier présente dans l'oxyde de chacun des deux atomes d'azote. Ceci, encore une fois, peut être expliqué par la stabilité des orbitales moléculaires résultant de la disproportion.
Dans l'image, le côté gauche du N2O3 correspond au NO, tandis que le côté droit au NO2. Logiquement, il est produit par la coalescence des oxydes précédents à des températures très froides (-20ºC). Le n2O3 est l'anhydride d'acide nitreux (HNO2).
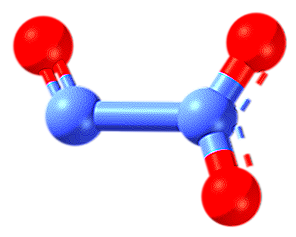
Dioxyde de carbone et tétroxyde d'azote (NO2, N2O4)
Lui non2 c'est un gaz brun ou brun, réactif et paramagnétique. Comme il a un électron non apparié, il se dimère (se lie) avec une autre molécule gazeuse NO2 pour former du tétraoxyde d'azote, gaz incolore, établissant un équilibre entre les deux espèces chimiques:
2NO2(g) <=> N2O4g)
Il est un poison et polyvalent, capable d'agent oxydant desproporcionarse leurs ions de réactions d'oxydo-réduction (oxyanions) NO2- et non3- (générer des pluies acides), ou dans le NO.
De même, le non2 est impliqué dans des réactions atmosphériques complexes provoquant des variations des concentrations d'ozone (O3) aux niveaux terrestre et dans la stratosphère.
Pentoxyde de diazote (N2O5)
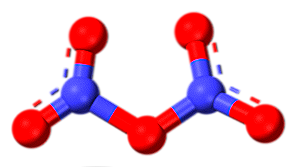 Le pentoxyde de diazote est un solide cristallin, anhydride d'acide nitrique (HNO)3), et est la forme la plus oxydée, par conséquent, la plupart des oxydants d’azote. en phase gazeuse, il est d'avoir une structure moléculaire telle que représentée sur l'image, mais l'oxyde en phase solide est formée par ion NO2+ et non3-.
Le pentoxyde de diazote est un solide cristallin, anhydride d'acide nitrique (HNO)3), et est la forme la plus oxydée, par conséquent, la plupart des oxydants d’azote. en phase gazeuse, il est d'avoir une structure moléculaire telle que représentée sur l'image, mais l'oxyde en phase solide est formée par ion NO2+ et non3-.
Lorsqu'il est hydraté, il génère HNO3, et à des concentrations plus élevées de l'acide, l'oxygène est principalement protoné avec une charge partielle positive -O+-H, accélérant les réactions redox
Références
- askIITians. ((2006-2018)). askIITiens. Récupéré le 29 mars 2018 auprès de askIITians: askiitians.com
- Encyclopaedia Britannica, Inc. (2018). Encyclopédie Britannica. Récupéré le 29 mars 2018 de l'Encyclopaedia Britannica: britannica.com
- Tox Town. (2017). Tox Town. Récupéré le 29 Mars 2018, Tox Ville: toxtown.nlm.nih.gov
- Professeur Patricia Shapley. (2010). Oxydes d'azote dans l'atmosphère. Université de l'Illinois. Récupéré le 29 mars 2018 de: butane.chem.uiuc.edu
- Shiver & Atkins. (2008). Chimie inorganique Dans Les éléments du groupe 15. (Quatrième édition., Pp. 361-366). Mc Graw Hill