Structure chimique du sulfure d'aluminium (Al2S3), nomenclature, propriétés
Le sulfure d'aluminium (Al2S3) est un composé chimique gris clair formé par l'oxydation de l'aluminium métallique en perdant les électrons du dernier niveau d'énergie et en devenant cation, et par la réduction du soufre non métallique, en gagnant les électrons produits par l'aluminium et en devenant un anion.
Pour que cela se produise et que l’aluminium puisse produire ses électrons, il est nécessaire de présenter trois3, qui permettent de former des liaisons avec des électrons provenant du soufre.

La sensibilité du sulfure d'aluminium à l'eau signifie que, en présence de vapeur d'eau dans l'air, il peut réagir pour produire de l'hydroxyde d'aluminium (Al (OH)).3), sulfure d’hydrogène (H2S) et de l'hydrogène (H2gazeux; si ce dernier s'accumule, cela peut provoquer une explosion. Par conséquent, l’emballage en sulfure d’aluminium doit être fait avec des contenants hermétiques.
D'autre part, le sulfure d'aluminium ayant une réactivité avec l'eau, cela en fait un élément qui n'a pas de solubilité dans ledit solvant.
Index
- 1 structure chimique
- 1.1 Formule moléculaire
- 1.2 Formule structurelle
- 2 nomenclature
- 3 propriétés
- 3.1 Propriétés physiques
- 3.2 Propriétés chimiques
- 4 Utilisations et applications
- 4.1 Dans les supercondensateurs
- 4.2 Dans les batteries lithium secondaires
- 5 risques
- 5.1 Procédure de premiers secours
- 5.2 Mesures de lutte contre l'incendie
- 6 références
Structure chimique
Formule Moléculaire
Al2S3
Formule structurelle
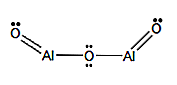 Nomenclature
Nomenclature
- sulfure d'aluminium.
- Di trisulfure d'aluminium.
- sulfure d'aluminium (III).
- sulfure d'aluminium.
Propriétés
Les composés chimiques présentent principalement deux types de propriétés: physiques et chimiques.
Propriétés physiques
Masse molaire
150,158 g / mol
Densité
2,02 g / ml
Point de fusion
1100 ° C
Solubilité dans l'eau
Insoluble
Propriétés chimiques
Une des principales réactions du sulfure d’aluminium est l’eau, en tant que substrat ou réactif principal:

Dans cette réaction, la formation d'hydroxyde d'aluminium et celle d'hydrogène sulfuré peuvent être observées si elle se présente sous forme de gaz ou de sulfure d'hydrogène si elle est dissoute dans l'eau sous forme de solution. Sa présence est identifiée par l'odeur des œufs pourris.
Utilisations et applications
Dans les supercondensateurs
Le sulfure d'aluminium est utilisé dans la fabrication de structures de nano-réseaux qui améliorent la surface spécifique et la conductivité électrique, de sorte qu'il est possible d'obtenir une capacité et une densité d'énergie élevées dont l'applicabilité est celle des supercondensateurs.
L'oxyde de graphène (GO) - le graphène est l'une des formes allotropiques du carbone - a servi de support au sulfure d'aluminium (Al2S3) avec une morphologie hiérarchique similaire à celle du nanoraptan fabriqué selon la méthode hydrothermale.
Action de l'oxyde de graphène
Les caractéristiques de l'oxyde de graphène en tant que support, ainsi que la conductivité électrique élevée et la surface, font du nanorambulant Al2S3 être électrochimiquement actif.
Les courbes de capacitance CV avec des pics redox bien définis confirment le comportement pseudo-capacitif des nanorambutans Al2S3 Hiérarchique, soutenue dans l'oxyde de graphène dans l'électrolyte NaOH 1M. Les valeurs de capacité spécifique CV obtenues à partir des courbes sont: 168,97 à la vitesse de balayage de 5 mV / s.
De plus, un bon temps de décharge galvanostatique de 903 μs a été observé, une capacité spécifique élevée de 2178,16 à la densité de courant de 3 mA / Cm2. La densité d'énergie calculée à partir de la décharge galvanostatique est de 108,91 Wh / Kg, à la densité de courant de 3 mA / Cm2.
L'impédance électrochimique confirme ainsi le caractère pseudo-capacitif de l'électrode de nano-ronflement hiérarchique Al2S3. Le test de stabilité de l'électrode montre une rétention de 57,44% de la capacité spécifique jusqu'à 1000 cycles.
Les résultats expérimentaux suggèrent que le nanorambutant Al2S3 La hiérarchie convient aux applications de supercapacités.
Dans les batteries lithium secondaires
Dans le but de développer une batterie secondaire au lithium à haute densité énergétique, le sulfure d’aluminium (Al2S3) comme matière active.
La capacité de décharge initiale mesurée à partir de Al2S3 était d'environ 1170 mAh g-1 à 100 mA g-1. Cela correspond à 62% de la capacité théorique de soufre.
Le al2S3 ont présenté une faible capacité de rétention dans la gamme de potentiel comprise entre 0,01 V et 2,0 V, principalement en raison de l’irréversibilité structurelle du processus de charge ou de l’extraction de Li.
Les analyses XRD et K-XANES pour l’aluminium et le soufre indiquent que la surface de Al2S3 réagit de manière réversible pendant les processus de chargement et de déchargement, tandis que le noyau Al2S3 ont montré une irréversibilité structurelle, car LiAl et Li2S ont été formés à partir d'Al2S3 dans le téléchargement initial et ils sont restés comme ils étaient.
Les risques
- Au contact de l'eau, dégage des gaz inflammables qui peuvent brûler spontanément.
- Provoque une irritation cutanée.
- Provoque une grave irritation des yeux.
- Peut causer une irritation respiratoire.
Les informations peuvent varier entre les notifications en fonction des impuretés, des additifs et d'autres facteurs.
Procédure de premiers secours
Traitement général
Consulter un médecin si les symptômes persistent.
Traitement spécial
Aucun
Symptômes importants
Aucun
L'inhalation
Prenez la victime à l'extérieur. Donner de l'oxygène si la respiration est difficile.
Ingestion
Administrer un ou deux verres d'eau et provoquer des vomissements. Ne jamais faire vomir ni donner quoi que ce soit par la bouche à une personne inconsciente.
La peau
Laver la zone affectée avec de l'eau et du savon doux. Retirez tous les vêtements contaminés.
Les yeux
Lavez-vous les yeux avec de l'eau, en clignotant souvent pendant plusieurs minutes. Retirez les lentilles de contact si vous en avez et continuez à rincer.
Mesures de lutte contre l'incendie
Inflammabilité
Non inflammable
Moyens d'extinction
Réagit avec l'eau. Ne pas utiliser d'eau: utiliser du CO2, du sable et de la poudre d'extinction.
Procédure de combat
Utilisez un appareil respiratoire autonome complet avec une protection complète. Porter des vêtements pour éviter le contact avec la peau et les yeux.
Références
- Salud y Riesgos.com, (s.f), Définition, concepts et articles sur la santé, les risques et l'environnement. Récupéré: saludyriesgos.com
- Sulfure d'aluminium. (s.f) Sur Wikiwand. Récupéré le 9 mars 2018: wikiwand.com
- Web Elements. (S.f) .Dialuminium Trisulpfide, récupéré le 10 mars 2018: webelements.com
- Iqbal, M., Hassan, M., M., Bibi.S., Parveen, B. (2017). Capacité spécifique élevée et densité d'énergie du nanorambutan hiérarchique Al2S3 à base d'oxyde de graphène synthétisé pour l'application de supercondensateurs, Electrochimica Acta, Volume 246 , Pages 1097-1103
- Senoh, H., T. Takeuchi, K. Hiroyuki, H. H. Sakaebe, K. Nakanishi, T. Ohta, T. Sakai, K. Yasuda. (2010). Caractéristiques électrochimiques du sulfure d'aluminium pour utilisation dans les piles au lithium.Journal des sources d'énergie,Volume 195, Numéro 24, pages 8327-8330 doi.org
- LTS Research Laboratories, Inc (2016), Fiche de données de sécurité Sulfure d'aluminium: ltschem.com



 Nomenclature
Nomenclature